- Blog
- Cos'è un indicatore acido-base? Scopria...
Sai che cos'è un indicatore acido-base? È una sostanza organica che colora la soluzione
Cos'è un indicatore? Gli indicatori sono sostanze organiche che hanno la proprietà di assumere colori diversi in base al pH di una soluzione in cui sono disciolti in quantità trascurabili rispetto alla concentrazione dei reagenti. Sono in grado di esibire una variazione di colore in corrispondenza del punto di equivalenza. È un fenomeno dovuto alle loro proprietà di acido o base debole, la cui forma coniugata è di diverso colore.
Ripetizioni e lezioni di chimica
In soluzione l'indicatore indissociato, HIn, partecipa all'equilibrio acido-base:
HIn + H2O--> In- + H3O+
HIn: forma acida (colore rosso) In-= forma basica (colore giallo)
Ka= KIn= [In-] [H3O+] / [HIn]
[H3o+]= KIn x [HIn]/[In-] = KIn x colore Rosso/ colore Giallo
scritta in forma logaritmica
pH= pKIn + log [In-]/[HIn] Equazione di Henderson-Hasselbach
Il pH della soluzione sposta l'equilibrio dell'indicatore verso la sua forma basica o acida. Possiamo trovarci in tre situazioni diverse:
pH > pKIn log [In-]/ [HIn] > 0 --> [In-]>[HIn]
L'indicatore esisterà in forma basica e impartirà alla soluzione la colorazione corrispondente: gialla.
pH< pKIn log [In-]/[HIn] <0 --> [In-]<[HIn]
L'indicatore esisterà in forma acida e impartirà alla soluzione la colorazione corrispondente : rossa.
pH=pKIn log [In-]/[HIn] = 0 --> [In-] = [HIn]
Non prevarrà nè la colorazione della forma basica nè quella della forma acida, l'indicatore impartirà una colorazione intermedia: arancione.
Poichè ad occhio nudo riusciamo a distinguere i due diversi colori (relativi alla forma acida e alla forma basica) quando praticamente la concentrazione di una delle due forme è almeno 10 volte più grande della concentrazione dell'altra si può concludere che:
Se [In-] = 10 [HIn] --> log [In-]/[HIn] = 1 pH= pKIn +1 colorazione della sua forma basica
Se [HIn] = 10 [In-] --> log [HIn]/[In-]= 1 pH= pKIn -1 colorazione della sua forma acida
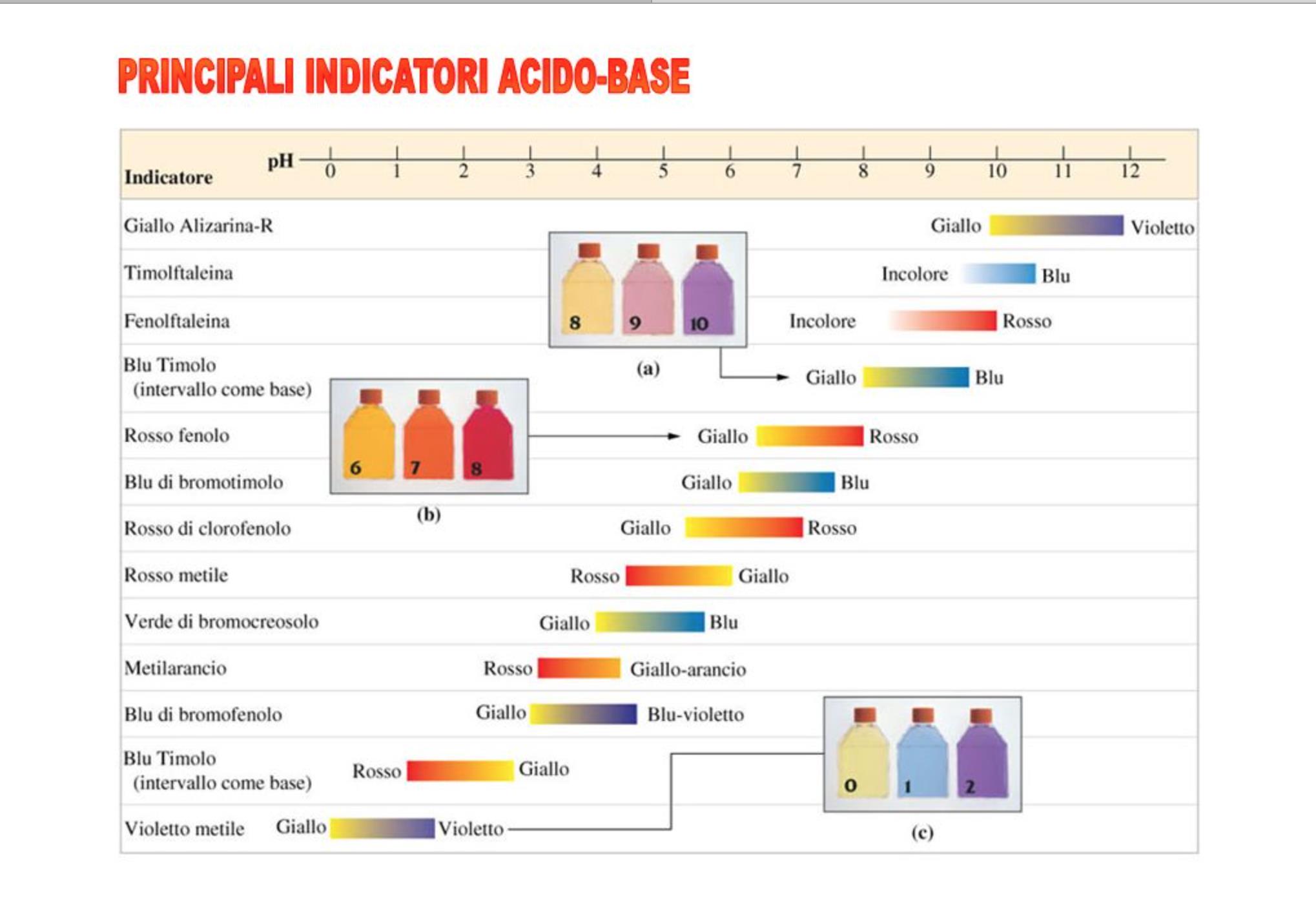
La scelta dell'indicatore si fa in modo che la variazione cromatica si manifesta al pH corrispondente al punto di equivalenza.
- Fenoftaleina pKIn= 9,4 Intervallo di viraggio 8,3 - 10,0 Incolore/ Rossa
- Rosso di metile pKIn= 5,1 Intervallo di viraggio 4,2 - 6,3 Rosso/Giallo
- Metilarancio pKIn= 3,7 Intervallo di viraggio 3,1 - 4.4 Rosso/ Giallo