Reazioni di sostituzione nucleofila SN SN2 ed eliminazione E1 E2
Quando viene trattato con un reattivo che ha caratteristiche nucleofile/o basiche un alogenuro alchilico può andare incontro a due tipi di reazione: sostituzione nucleofila (SN1 SN2) ed eliminazione (E1, E2, E1cb) teoricamente in competizione fra di loro.
Scopriamo di più in questo articolo dedicato a un tema non spesso affrontato durante le lezioni di chimica.
Analizziamo due reazioni: sostituzione nucleofila SN SN2 ed eliminazione E1 E2
SN2
Nella sostituzione nucleofila bimolecolare la reazione procede in un singolo stadio in cui il nucleofilo attacca il substrato e contemporaneamente il gruppo uscente si allontana.
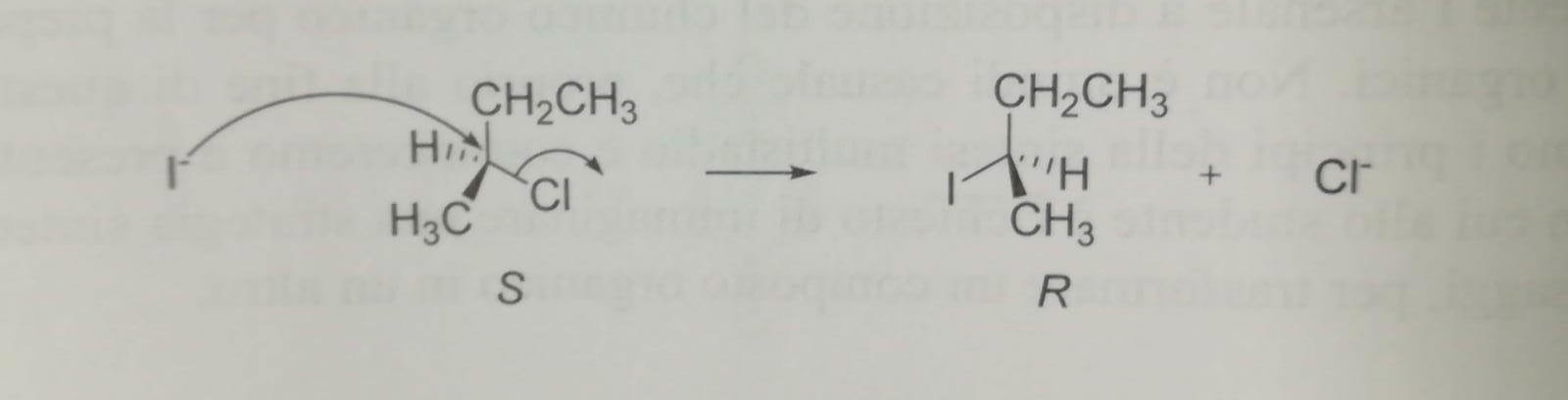
Questo meccanismo richiede che il carbonio che subisce l'attacco abbia il minor impedimento sterico possibile e quindi è possibile solo su carboni metilici, primari e secondari, su substrati terziari è praticamente impossibile. Anche le ramificazioni sui carboni adiacenti quello che subisce l'attacco del nucleofilo rallentano la reazione e se è presente una doppia ramificazione la reazione può avvenire solo in condizioni molto drastiche.
Se il carbonio oggetto di SN2 è un carbonio chirale si può avere l'inversione di configurazione. Questo è certo se il gruppo entrante ha la stessa priorità del gruppo uscente e quindi si ha il passaggio R>S oppure S>R.
La reazione di sostituzione nucleofila bimolecolare è favorita da nucleofili molto forti come OH-, SH-, RO-, CH3COO-, I-, Cl-, Br- e da solventi polari e aprotici che stabilizzino la carica del gruppo uscente come DMF, etere etilico, DMSO.
SN1
Nella sostituzione nucleofila monomolecolare si ha un primo passaggio lento nel quale si ha la rottura eterolitica del legame carbonio alogeno formando un carbocatione. Nel secondo stadio che è molto veloce, il nucleofilo attacca il carbocatione legandosi quindi al carbonio
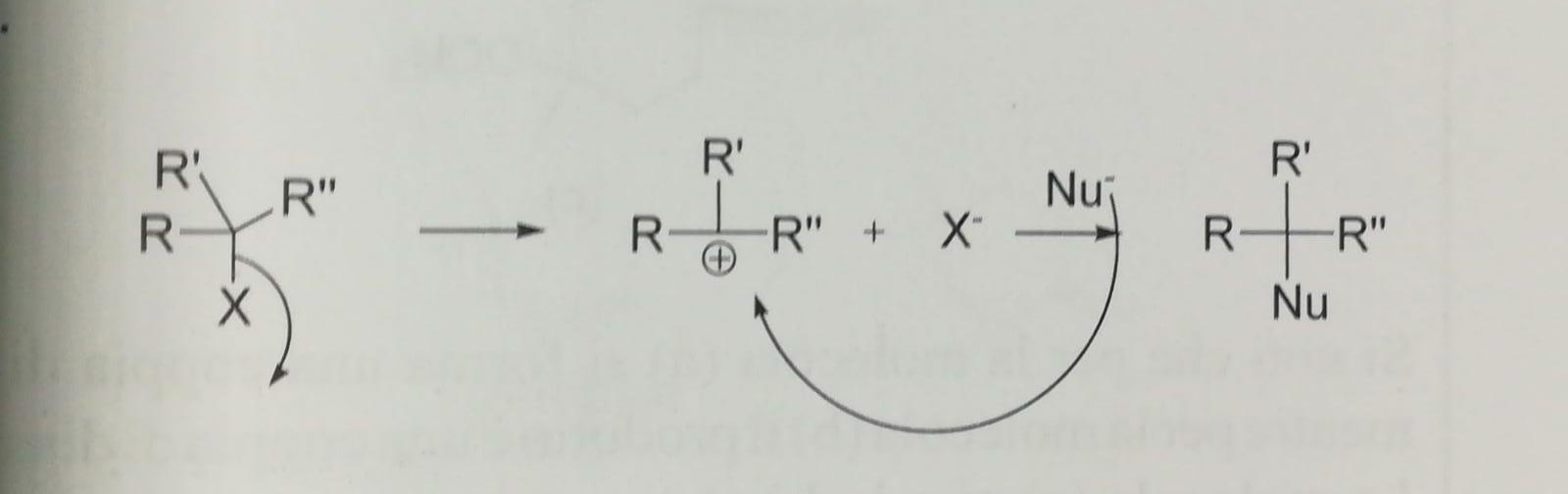
Il nucleofilo entrante non deve avere caratteristiche basiche altrimenti prevarrà la reazione di eliminazione e la formazione di un alchene.
Poiché la formazione del carbocatione è lo stadio determinante la reazione, questa può avvenire semplicemente solo con carbocationi terziari o secondari con più difficoltà. Su alogenuri primari e metilici non avviene mai, fanno eccezione gli alogenuri allilici e benzilici che possono formare carbocationi stabilizzati per risonanza.
Dal punto di vista stereochimico la reazione di sostituzione nucleofila monomolecolare porta alla formazione di una miscela racemica poiché il carbocatione che si forma nel primo stadio è una specie chimica planare e quindi il nucleofilo può attaccare il carbonio da entrambe le facce in maniera casuale.
Le SN1 sono sempre accompagnate da una certa quantità di prodotti di eliminazione E1 che possono essere limitati variando le condizioni di reazione ma mai completamente eliminati e da alcuni prodotti dovuti al riarrangiamento del carbocatione una volta formatosi, sopratutto nel caso il carbocatione che si formi derivi da un carbonio secondario.
Questa reazione è favorita da solventi polarie protici in grado di stabilizzare la carica positiva del carbocatione separato dal nucleofilo uscente. Il nucleofilo entrante deve essere debole e poco basico per non favorire la reazione di eliminazione concorrente.
Esempi di buoni nucleofili per reazioni SN1 sono l'acqua e gli alcol.
E2
La reazione di eliminazione E2 porta alla formazione di un doppio legame per allontanamento contemporaneo del gruppo uscente e di un protone dall'atomo di carbonio adiacente al carbonio con l'alogeno che viene strappato da una base.
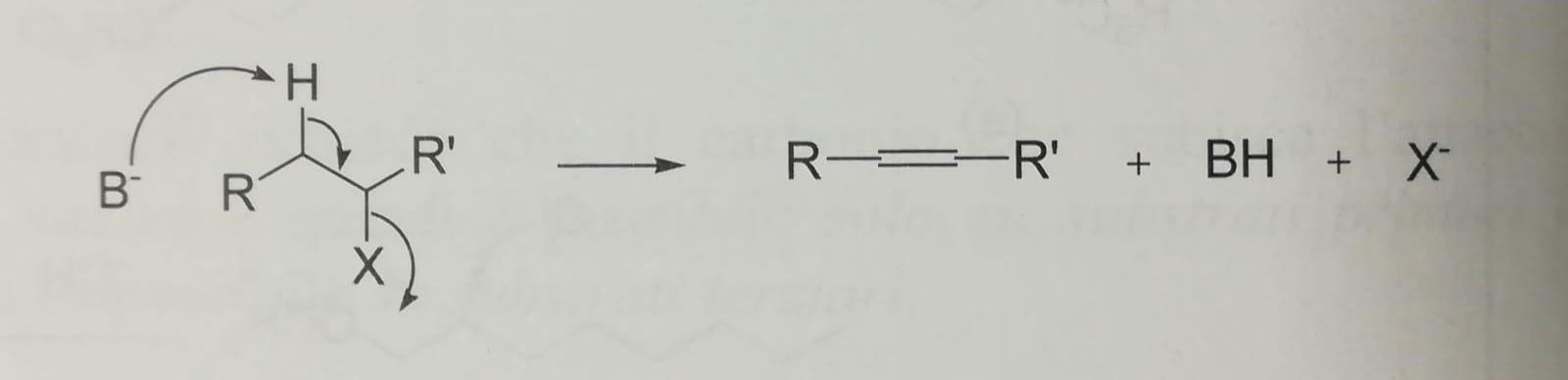
La reazione E2 è favorita dall'ingombro sterico del substrato, dalla elevata basicità del nucleofilo entrante e dal suo ingombro sterico.
Per quanto riguarda la regiochimica, il nucleofilo-base strappa preferenzialmente il protone dal carbonio adiacente con meno idrogeni ossia si forma l'alchene più sostituito cioè quello con meno idrogeni (Regola di Zaitsev).
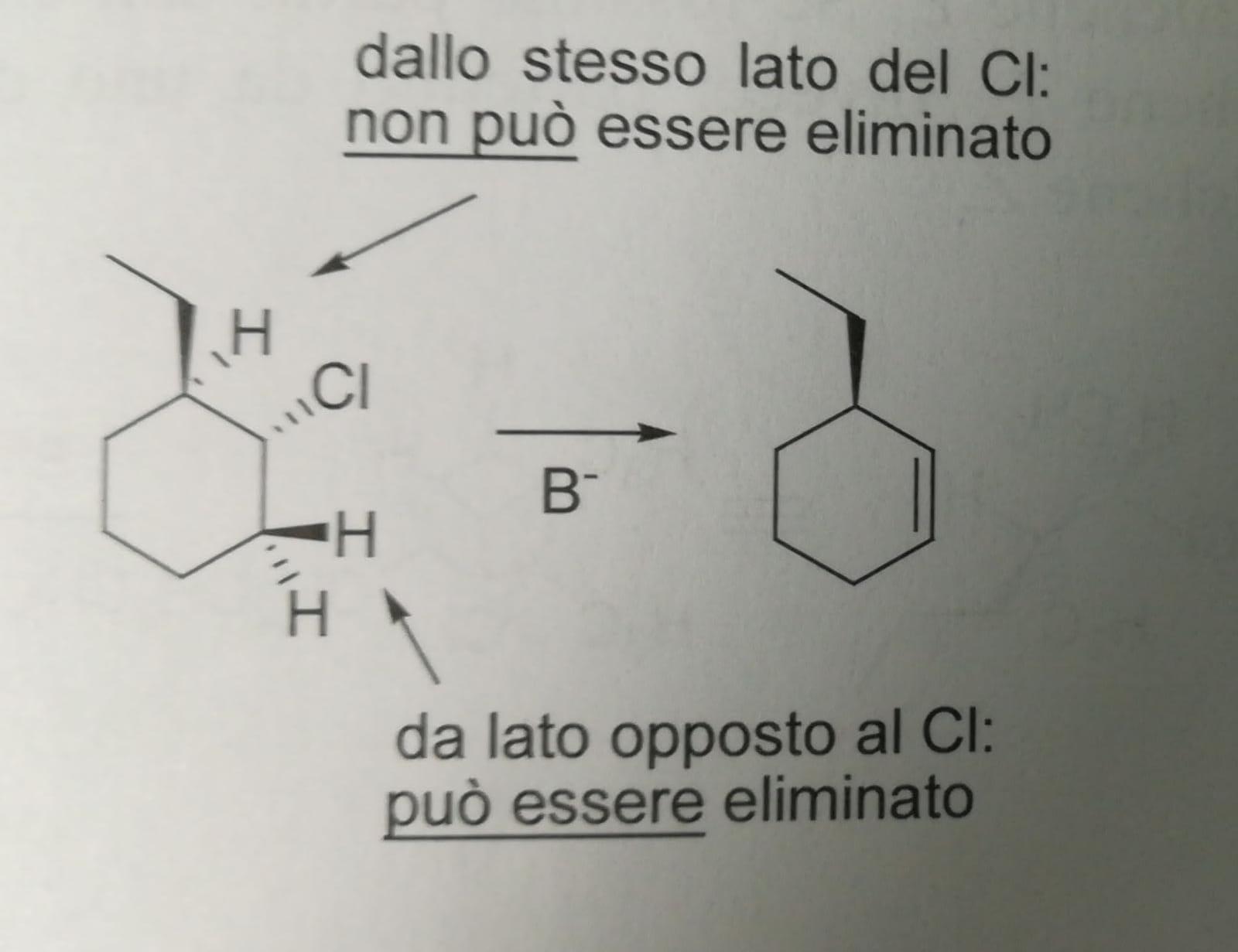
Per quanto riguarda la stereochimica la reazione E2 procede generalmente con approccio anti-coplanare, ciò significa che i due gruppi che devono allontanarsi, cioè l'idrogeno e l'alogeno devono trovarsi da parti opposte del piano della molecola.
E1
Nella reazione di eliminazione E1 una volta formatosi il carbocatione, il nucleofilo non si lega al carbonio con la carica positiva ma strappa un idrogeno al carbonio adiacente portando alla formazione del doppio legame.
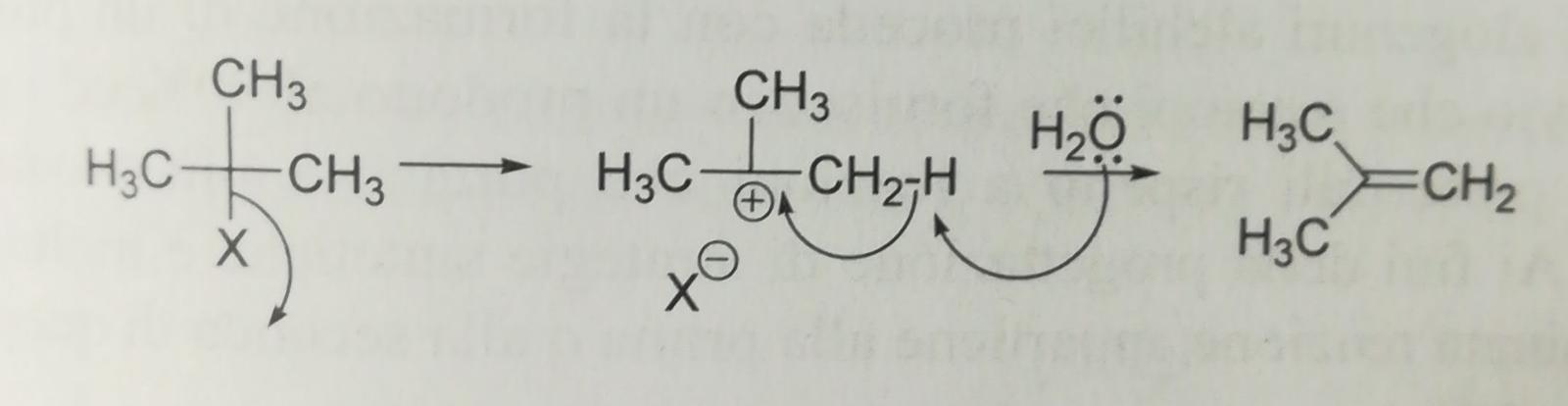
Al contrario della reazione E2, poiché la reazione E1 procede in due tempi, non è necessario il requisito della anticoplanarietà, pertanto la reazione non ha nessuna stereospecificità e porterà a una miscela di prodotti quando possibile.
Speriamo che ora sia tutto più chiaro! Se hai bisogno di ulteriore aiuto, un insegnante di chimica online potrebbe essere la miglior soluzione!


